Er ist so nah und doch so fern, der Pflanzenhauptnährstoff Stickstoff (N). Obwohl Luft zu einem großen Teil aus Stickstoff besteht (78 %), ist er für Pflanzen nicht verfügbar. Erst Bakterien, teils in Symbiose mit Leguminosen, können ihn für sie aufnehmbar machen.
Reich an Stickstoff, mit einem mehr oder weniger großen Teil an pflanzenverfügbarem Anteil, sind tierische Ausscheidungen. In diesen wie auch im Boden liegt der Stickstoff in zwei Formen vor: organisch gebunden und anorganisch.
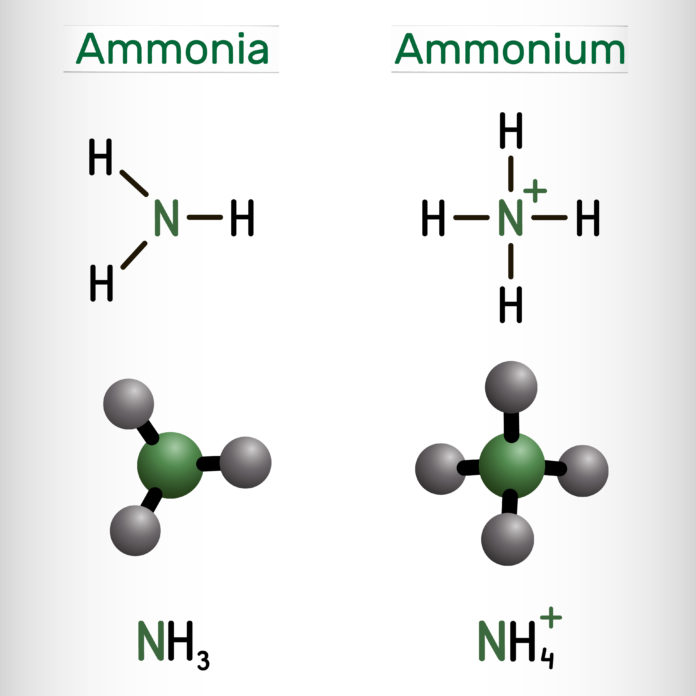
Die Wurzeln der Pflanze können anorganischen Stickstoff als Ammonium (NH4+) und als Nitrat (NO3–) aufnehmen. Letztere Stickstoffverbindung wird unter Beteiligung von Bodenorganismen aus dem Ammonium gebildet und ist als Anion sehr mobil. Nitrat kann daher über das Sickerwasser leicht ins Grundwasser gelangen. Ammonium hingegen wird am negativ geladenen Sorptionskomplex des Bodens teilweise angelagert und ist weniger mobil.
Ammonium steht mit dem gasförmigen Ammoniak (NH3) in einem chemischen Gleichgewicht, dessen Lage vom pH-Wert bestimmt wird. Je höher dieser ist, umso mehr verschiebt sich dieses Gleichgewicht in Richtung Ammoniak und umso größer sind die potenziellen Verluste durch Ammoniakausgasung.
- Bildquellen -
- Ammonium und Ammoniak: bacsica – stock.adobe.com



































